免疫印迹(WB)是在SDS-PAGE的基础上,将胶上的蛋白转移至NC膜或者PVDF膜上,利用抗体-抗原特异性相互作用,逐步通过连续性的信号对称,用化学发光或者化学显色的方式将抗原呈现出来,WB是目前三大印迹法中应用最为广泛的一种。
(一)样品制备部分
本文提供了3种样品制备方法,分别是:单层贴壁细胞,悬浮细胞与组织。请根据自己的样品类型选择合适的样品制备方法。
1贴壁细胞
1.1在100 mm x 20 mm培养皿中使细胞长至接近饱和度,除去培养基并用室温的1x PBS缓冲液冲洗细胞单层。以下步骤应在冰上或在4°C下使用新鲜的冰冷缓冲液进行。
1.2将0.6 ml RIPA缓冲液(Total蛋白检测:添加蛋白酶抑制剂;磷酸化蛋白检测:添加蛋白酶抑制剂+磷酸酶抑制剂)添加到平板中的单层细胞中,在4°C下轻轻摇动平板15分钟,用细胞刮刀刮起粘附的细胞。
1.3将得到的裂解液转移到微量离心管中,用0.3 ml 新鲜的RIPA缓冲液洗涤平板一次,然后与第一裂解液合并,并在冰上温育30–60分钟。
1.4在4℃下10,000x G离心细胞裂解液5分钟。将上清液转移到新的微量离心管中,得到细胞总裂解物。
为了提高蛋白质回收率,可以将沉淀重悬于0.1ml新鲜的RIPA中,离心并与上述上清液并。
2悬浮细胞
2.1在室温下通过低速离心5分钟(例如300x G)收集大约2.0 x 107个细胞。
2.2小心地除去培养基,并用室温的PBS洗涤沉淀,然后通过低速离心再次收集。
2.3小心地去除上清液,添加1.0 ml冰冷的RIPA缓冲液(Total蛋白检测:添加蛋白酶抑制剂;磷酸化蛋白检测:添加蛋白酶抑制剂+磷酸酶抑制剂),用1ml移液器将细胞轻轻重悬在RIPA缓冲液中,并在冰上孵育30分钟,然后用21号针头注射器,或杜恩斯匀浆器,或超声进一步破坏并匀浆细胞,若使用超声破碎应将时间控制在10-15秒,注意不要升高裂解液的温度,在冰上孵育30分钟。
2.4然后转移至微量离心管中,并在4°C下以10,000x G离心10分钟。
2.5将上清液转移到新的微量离心管中,得到细胞总裂解物。
为了提高蛋白质回收率,将沉淀重悬于少量RIPA中,离心并合并上清液。
3组织样品
3.1称量组织,然后使用干净的解剖刀切成小块(图1左上)。 冷冻的组织应切成薄片(图1右下),并在RIPA缓冲液(Total蛋白检测:添加蛋白酶抑制剂;磷酸化蛋白检测:添加蛋白酶抑制剂+磷酸酶抑制剂)中解冻。
3.2 按照重量体积比1:3的比例,每克组织使用3 ml的冰冷RIPA缓冲液,然后用组织匀浆器充分破碎组织,在整个过程中将温度保持在4°C,在冰上孵育30分钟。
3.3转移到微量离心管中,在4°C以10,000x G离心10分钟。
3.4轻轻的吸取上清至新的离心管,并再次离心,将上清液转移至新离心管中,获得组织总裂解物。
为了获得澄清的裂解物,可能需要更长的离心时间。
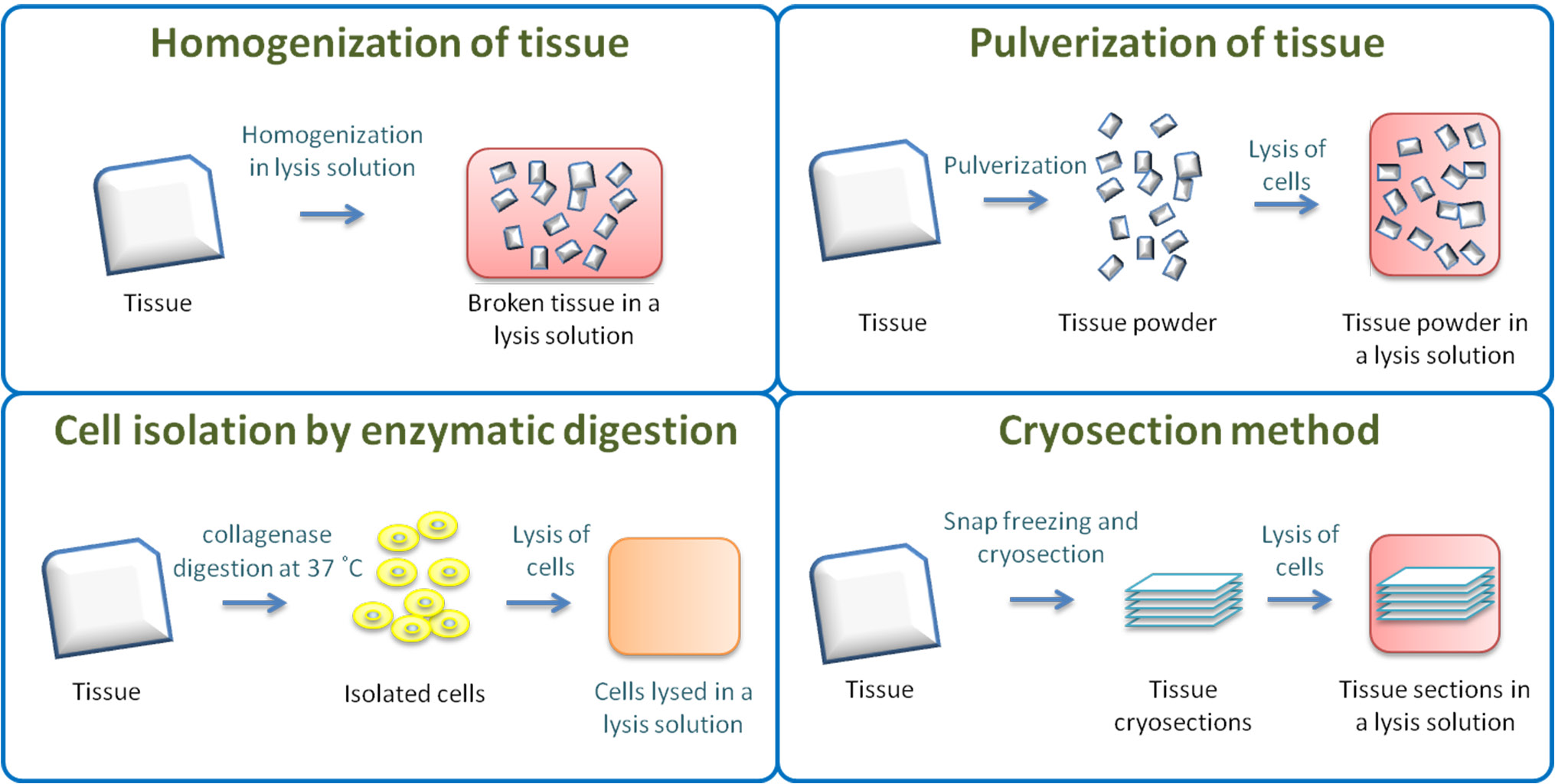
图1
(材料清单)
|
产品名称 |
品牌 |
货号 |
规格 |
|
RIPA缓冲液 10X |
Millipore |
20-188 |
100ml |
|
蛋白酶抑制剂 |
Roche |
5892970001 |
300ml |
|
磷酸酶抑制剂 |
Roche |
4906837001 |
200ml |
|
杜恩斯匀浆器 |
Kimble |
885300 |
2ml |
|
组织匀浆器 |
MBT |
MBT2ML |
2ml |
(二)电泳与转膜部分
1 电泳
1.1电泳前需对样品进行蛋白定量,以便于调整泳道之间的总蛋白均一性,可用BCA方法对获得的蛋白裂解物进行定量。
1.2将样品(每泳道全细胞裂解物按 40–60 µg,核提取物按 10–20 µg,转染的裂解物按 5-10 µg或10–20 ng纯化的蛋白)按3:1与4x电泳样品缓冲液混合(低蛋白浓度样品可以用5X的样品裂解液),并在95度金属浴或水浴中煮2-3分钟。未使用的样品可在-80°C下保存。
注释:对于1.0 mm厚度的凝胶,10孔的最多可加44 ul,15孔的最多26 ul;对于1.5 mm厚度的凝胶,10孔的最多可加入66 ul,15孔的最多40 ul样品。预染Marker一般上样量为5-10 ul,具体用量可参考产品说明书。
1.3可选择预制胶或者用制胶试剂盒制备符合自己所研究的蛋白分子量的胶(表),将配置好的胶放入电泳槽,加入足够量的电泳缓冲液,一般90V压胶30min后120V电泳1-2小时(具体方案请参考电泳槽生产企业的使用说明)。
|
分子量 |
胶浓度 |
|
4–40 kDa |
20.0% |
|
12–45 kDa |
15.0% |
|
10–70 kDa |
12.5% |
|
15–100 kDa |
10.0% |
|
25–100 kDa |
8.0% |
2 转膜
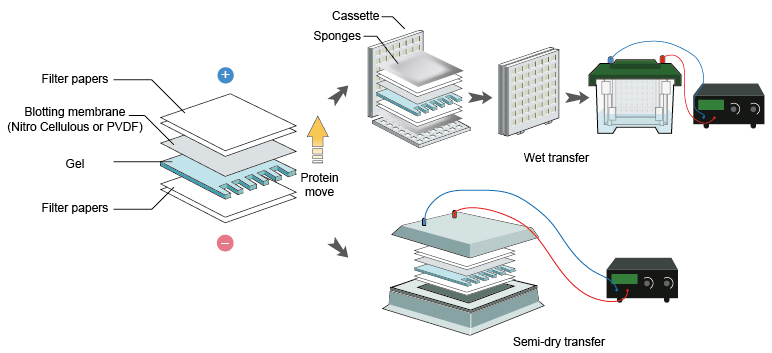
2.1电泳完将胶取下,与海绵,转印纸一起在转移缓冲液中平衡10分钟。
2.2按照图(2)的方向组装好三明治结构,放入含有转膜缓冲液的转移槽中,恒流或者恒压转移1-2小时,电流300毫安或电压100V(具体转膜方案请参考设备生产企业的使用说明)。
2.3转膜后将膜放入TBST中清洗5min。
图(2)
(材料清单)
|
产品名称 |
品牌 |
货号 |
规格 |
|
BCA |
Thermo |
23227 |
500ml |
|
LDS Sample Buffer (4X) |
Invitrogen |
NP008 |
250ml |
|
DDT |
Wako |
048-29224 |
5G |
|
预染Marker 10-180 kDa |
Thermo |
26617-1 |
250ul |
|
12孔预制胶 1.0mm |
MBT |
MBT5475 |
30块 |
|
制胶试剂盒 |
Cwbiotech |
CW0022S |
40块 |
|
Tween 20 |
Vetec |
V900548 |
100ML |
(三)免疫检测
1封闭
1.1转膜后需要对膜上的非特异性结合位点进行封闭,一般用5%脱脂奶粉/TBST在室温下孵育膜60分钟,如依然出现非特异性条带时,可选择在4°C封闭过夜。
注意:如果使用磷酸化抗体,则需要将封闭剂更换成BSA或其他不含磷酸酶或磷酸肽的封闭剂。
2一抗孵育
2.1将封闭的膜用TBST清洗一次,5min;
2.2 将一抗按照推荐工作浓度加入在1%NFM/TBST中(Santa单抗一般使用2.0 µg / ml),37°C孵育1小时,如信号比较弱时,可改成4°C孵育过夜;
注意:当检测磷酸化抗体时,应将脱脂奶粉更换成BSA。
2.3用TBST清洗膜3次,每次5分钟。
注意:如果选择HRP直标的一抗,则可跳过步骤3.二抗孵育进入4.检测。
3二抗孵育
3.1将HRP标记的二抗按照推荐的工作浓度加入1%NFM/TBST中,在37°C中与膜孵育45min。 如果观察到高本底,则应进一步稀释二抗或检测试剂(最高至1:20,000)。
注意:当被检测标本是组织样本时,应考虑组织中存在IgG并有可能被二抗识别,从而导致产生25kDa与55kDa的干扰条带,这时应该选择预吸附的二抗,如人源标本应选择预吸附Human IgG的二抗,以此类推。(推荐Jackson 预吸附二抗)
4 检测
4.1将膜用TBST洗涤3次,每次5分钟,之后用TBS洗涤5分钟;
4.2根据化学发光ECL试剂的说明书,将发光液加入膜中孵育,并进行曝光。
(材料清单)
|
产品名称 |
品牌 |
货号 |
规格 |
|
PVDF膜 |
Millipore |
ISEQ00010 |
26.5 cm x 3.75 m |
|
脱脂奶粉 |
Wako |
198-10605 |
500G |
|
BSA |
Sigma |
B2064-100G |
100G |
|
抗兔IgG-HRP |
Jackson |
111-035-003 |
2ml |
|
抗小鼠IgG-HRP |
Jackson |
115-035-003 |
2ml |
|
ECL |
Millipore |
WBKLS0500 |
500ml |
未经书面授权,本页面内容、图片和设计不得以任何形式进行复制
