本产品是质谱分析前处理时常用的蛋白分解酶即赖氨酰肽链内切酶,该酶可以特异性切除赖氨酸基团C末端的多肽,可用于蛋白测序分析和 Lys-X 化合物的酶合成。若同时使用赖氨酰肽链内切酶和胰酶,可更好地切断赖氨酸基团的多肽,增加多肽的数量。产品已按照使用习惯做成小包装,是方便使用的冷冻干燥品。20 μg/支可用于100-200个样品的凝胶内消化。
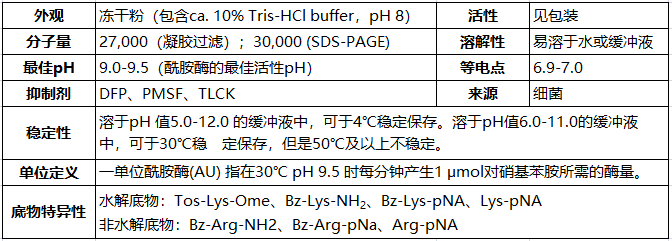
外观:冻干粉(包含2 mmol/L Tris-HCl缓冲液,pH 8)
分子量:27,000(琼脂糖过滤),30,000(SDS-PAGE)
稳定性:溶解于pH值5.0-12.0的Tris缓冲液中,可在4℃稳定保存2年;在pH值6.0-11.0 30℃时能稳定保存,但温度超过50℃时不稳定。
可水解底物——Tos-Lys-OMe,Bz-Lys-NH2,Bz-Lys-pNA,Lys-pNA
不可水解底物——Bz-Arg-NH2,Bz-Arg-pNA,Arg-pNA
分别采用胰蛋白酶(Tp)、赖氨酰肽链内切酶 (Lys-C) 和Tp与Lys-C联用进行胶内酶切的效果比较。
牛血清蛋白BSA 的条带(100 ng) 通过SDS-PAGE 获得,然后分别用Tp、Lys-C和Lys-C+Tp进行酶切,再用MALDI-TOFMS法进行分析。
表 1:Tp、Lys-C和Lys-C+Tp的结果对照
这些结果表明Lys-C酶解的错误裂解率最低。Tp酶解时加入Lys-C后,错误裂解率有所降低,同时,可以鉴定出更多的多肽。
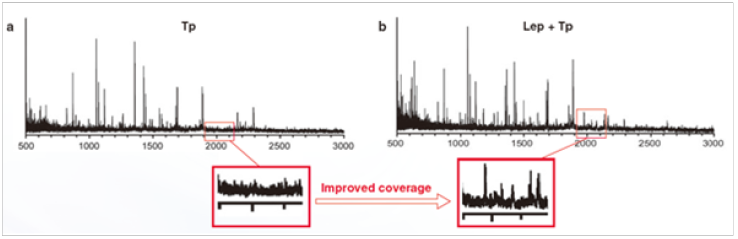
胰蛋白酶 (Tp)( 图 a) 和赖氨酰肽链内切酶 (Lys-C)+Tp ( 图 b) 酶切后的质谱结果对照图。
Lys-C+Tp酶切后,可以在m/z=2000时得到吸收峰,而单独的Tp酶切在m/z=2000时没有吸收峰。该结果表明Lys-C可以提高测序覆盖度。
( 数据由大阪医疗中心和妇婴健康研究所Y. Wada博士提供 )
赖氨酰肽链内切酶,最初由Masaki 等人从土壤细菌中分离得到。该酶可以特异性剪切赖氨酸残基C 末端和S-氨乙基半胱氨酸残基的肽键,用于蛋白测序和Lys-X化合物的酶催化合成。该酶稳定性高,在4M 尿素或0.1%SDS 溶液中30℃孵育6小时之后,仍然拥有完整的生物活性。